
結婚指輪には様々な金属を使います。金、プラチナなどの貴金属や、 レアメタルと言われるタンタル、チタン、ジルコニウムなどなど。
それぞれ色とか硬さとか(金額とか)に違いがあるわけですが、そもそもそれってなんの違いなのでしょうか?
そんなことが気になってしまったので、知っているようで知らない金属のあれこれについてまとめてみました。
元素や原子って何?
今回は最も人気のある金とプラチナについて。まずその根本的な違いから説明すると、この2つはそもそも異なる「元素」です。ご存じの方も多いかと思いますが、異なる元素ということは、全く異なる物質ということです。
元素についてもう少し説明すると、理科の授業で習った「元素周期表」にのっている水素や酸素といった物質の種類です。これまでに知られているのは118種類で、それで地球上のすべての物質を構成しています。それぞれの「元素」には「原子番号」が付けられていて、その番号によってどのような元素なのかがわかるようになっています。
原子モデル
この「元素」を構成する物質が「原子」です。水素で言えば「水素」というのが元素の名前で、実際には「水素原子」が様々な物質を構成しています。例えば水(H2O)は、2つの水素原子と1つの酸素原子で構成されています。金は金原子の集まりで、プラチナはプラチナ原子の集まりです。 そしてその「原子」は原子核とその周りを回る電子からできています。
まず原子核について説明すると、原子核は陽子と中性子から出来ています。陽子や中性子の性質まで説明すると大変なので、ここでは、陽子の数が「原子番号」を決め、陽子と電子の数は同じだということをまず説明しておきます。
電子が元素の性質を決める?
そして、元素の物理的・科学的な性質を決める大きな要因が「電子配置」です。原子では原子核の周りを電子が回っているわけですが、回っている電子の数は一番少ない水素で1個、酸素で8個、銀なら47個、プラチナは78個、金は79個というようになっていて、電子は電子殻という層を形成し、どのように回っているのか示すのが「電子配置」です。
では、「電子配置」がどのように元素の性質を決めるのでしょうか?電子が回っている電子殻は内側から、K殻、L殻、M殻、N殻、O殻、P殻、Q殻とあって、それぞれ回ることができる電子の最大数が2個、8個、18個、32個、32個、18個、8個と決まっています。さらにその殻の中にs、p、d、fという最大で4種類の軌道があって、電子はその軌道上を回っています。
円を描いて回っているものもあれば、8の字を描いて回っているものもあるというようなイメージです。
(※実際の電子は、ぐるぐる回っているのではなく雲のように3次元的な空間に存在する「確率密度」で示します。)
そして、その電子配置の中でも、一番重要なのが「最外殻」つまり、原子核から一番離れたところを回っている電子の軌道なのです。なぜかというと、一番外の軌道を回っている電子は外部の影響を受けやすく、電子が出たり入ったりしやすくなるからです。電子の軌道には「安定数」があり、決まった数より電子が多かったり少なかったりすると、電子を放出したり受け取ったりして安定数になろうとする性質があります。
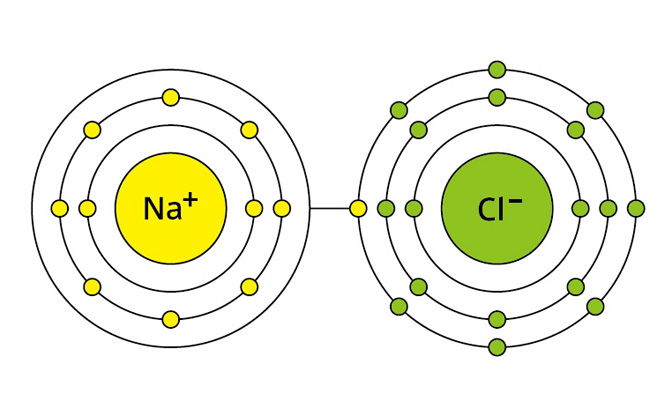
例えばナトリウム(Na)という元素がありますが、この元素はM殻の電子が1つしかないので、電子が原子から離れやすくなっています。
これに対して、塩素(Cl)は、M殻の電子が7つで、もう1つ電子が増えるとM殻のp軌道が安定するので、電子を受け取りやすくなります。ナトリウムは電子を放出すると陽イオン(ナトリウムイオン)というものになり、塩素は電子を受け取ると陰イオン(塩化物イオン)というものになります。陽イオンは+の電荷、陰イオンは-の電荷を帯びているので、磁石のように引きつけられて結合し、食塩(NaCl)という化合物になり、これをイオン結合といいます。
(※ナトリウムと塩素の電子配置)
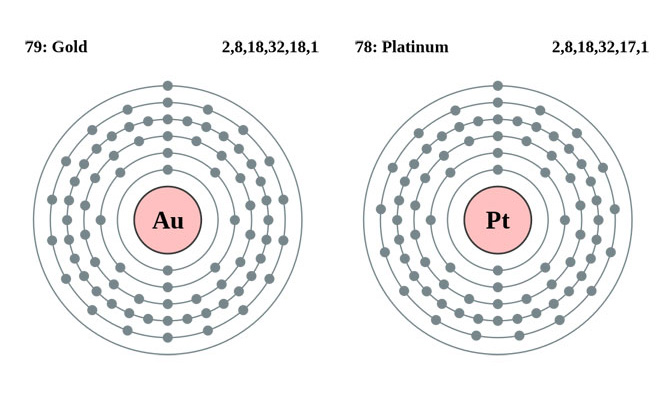
金やプラチナの場合はどうでしょうか。金もプラチナも実は、最外殻のP殻に電子を1つ持っています。ということは、電子を放出して陽イオンになりやすいわけですが、金属が結合する場合はイオン結合ではなく、金属結合という方法で結合します。これは、陽イオン同士が結びつき、放出された電子(たち)をたくさんのイオンで共有するという結合方法です。
(※金とプラチナの電子配置)
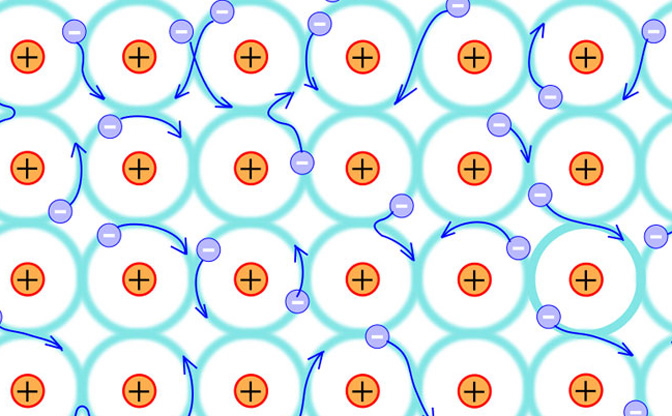
イオン同士がしっかり結びつき、その間を電子(自由電子という)が飛び回っているというイメージです。この自由電子がマイナスの電荷を帯びて動きまわることで、金属に電気や熱を伝えやすいなどの特徴を生んでいるのです。
そして、もう1つこの自由電子が生み出す金属の特徴が「光沢」です。金やプラチナが光り輝いているのもこの自由電子のおかげなのです。

金とプラチナの色の違いは?
自由電子が光を反射するメカニズムは、光が金属に入ってくると、自由電子は光のエネルギーを使ってプラズマ振動という振動を起こし、光を反射するというものです。それで金属は光るのです。ただ、金属によってこの自由電子の密度が異なり、一部の光が吸収されるため、輝きに違いが生まれるといいます。例えば、鉄がプラチナや銀よりも暗い色をしているのも、この要因によるものと思われます。
さらに、金属の「色」の違いにはもう1つの要因があります。それは、自由電子ではないもともと原子に含まれている電子を原子核が引っ張る力の違いです。金もプラチナも最外殻に電子を1つ持っていると書きましたが、金とプラチナの違いは、その1つ内側のO殻の電子の数が金は18個、プラチナは17個というところにあります。そして、O殻は電子18個で安定するのですが、この違いが原子核の引っ張る力の違いを生み、色の違いを生み出しているのです。
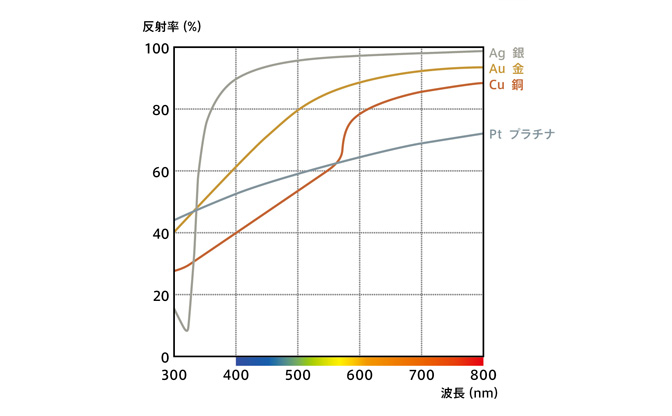
色が異なる理由は、反射する光の違いです。光にはさまざまな波長があります。身近なところでは、波長が短いのが紫外線で、波長が長いのが赤外線、その間に可視光線があります。波長が短いということは、振動数が多いということになり、さらに言うと高エネルギーだということになります。
金属は全体的に高エネルギーの光ほど反射しづらいのですが、プラチナの場合はその変化が緩やかなのに対し、金は「青」より波長が短い光の反射率が急激に落ちるという特徴があります。それによって金は黄色く見えるのです。
同じような特徴を持つ金属に銅があります。銅は「黄色」より波長が短い光を反射しないので、赤っぽく見えます。そして、銀はすべての可視光を反射しますが、実は紫外線の波長で反射率が急激に落ちるという特徴を持っています。 これが金や銅が他の金属と違う色をしている理由です。
また、この金、銅、銀に共通するのは、最外殻の1つ内側の殻が安定しているということで、元素周期表では縦に並んでいます。電子配置において最外殻(とその1つ内側の角)の電子の数が同じなので3つはとても似た性質を持っているのです。

金色以外の金とプラチナの違い
金色以外にも金とプラチナには、色々な違いがあります。例えば、プラチナは物質の反応を助ける「触媒」としての役割があり、現在も燃料電池などさまざまな先端技術で欠かせないものとなっています。これに対して、金は触媒としての働きはほとんどしません。実はこれも、金とプラチナの電子配置の違いによるものなのです。
いろいろな金属の違いも、じつはミクロの原子や電子の世界で説明できるってすごいと思いませんか?指輪選びの参考にはならないと思いますが、金属って面白いなと思ってもらえれば嬉しいです。



